關鍵腦區與疲勞調控
前額葉皮層是疲勞調控的核心區域。通過孟德爾隨機化分析發現,右側外側眶額葉、左/右尾中額葉和右側吻側中額葉的灰質體積與疲勞風險顯著負相關。體積較大的個體在警覺性任務中表現更優,表明這些區域通過調節注意力和情緒降低疲勞感。
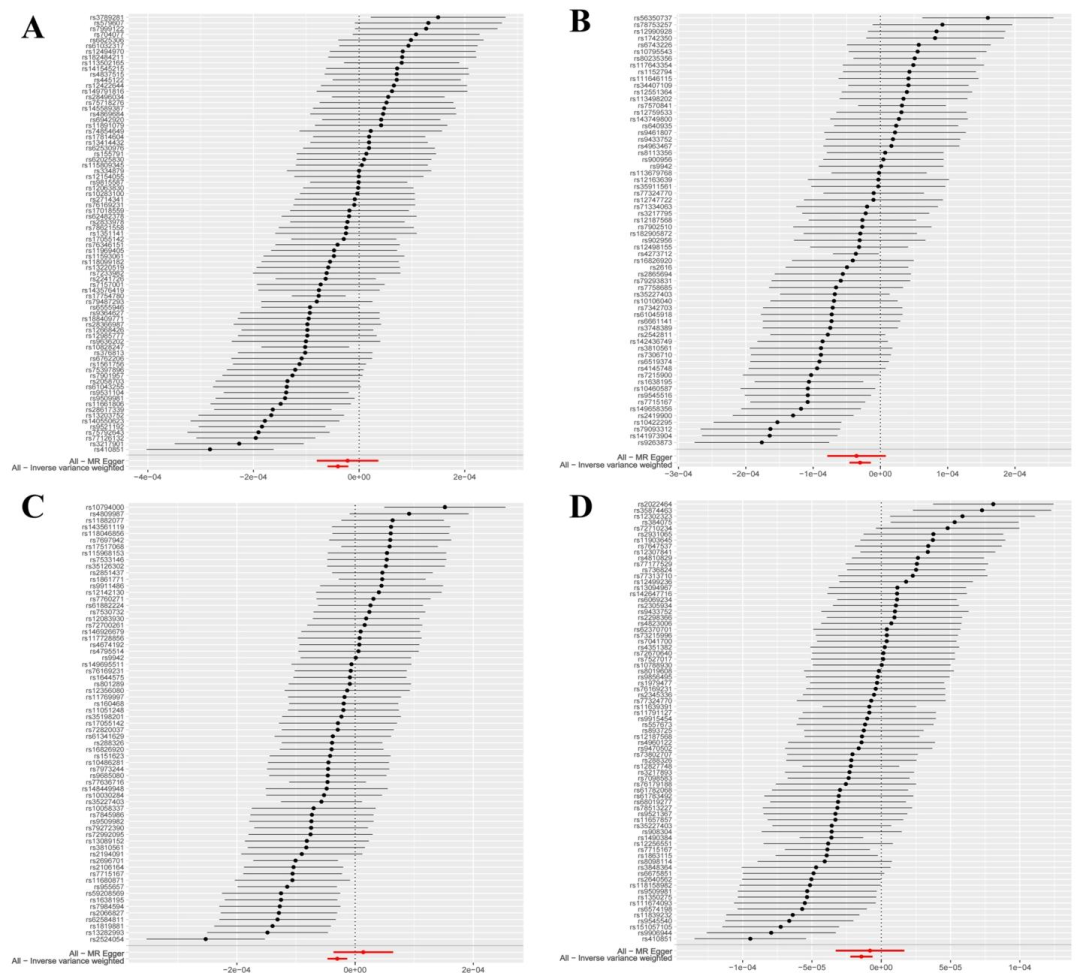
四個腦區與發生疲勞的風險顯著呈負相關
此外,前扣帶回皮層(ACC)整合獎勵價值與能量消耗信息,決定是否繼續任務,當能量成本超過預期獎勵時,ACC活動減弱,觸發疲勞信號。
獎賞價值和厭惡價值進行編碼后傳遞到前扣帶回皮質(ACC)
伏隔核(NAc)和眶額葉皮層(OFC)也參與疲勞機制。伏隔核通過多巴胺信號調節動機強度,而OFC評估任務獎勵與風險。動物實驗顯示,NAc多巴胺耗竭會減少高努力選項的選擇,說明其直接關聯努力決策。
基因調控與氧化應激
通過基因共定位分析,發現ECE2、GPX1和SNF8在額葉皮層中與疲勞顯著相關。大鼠實驗顯示,中樞疲勞大鼠模型行為測試表現出學習記憶下降等癥狀,以及中樞疲勞大鼠模型額葉皮質中這些基因的mRNA水平顯著升高。
ECE2:與神經退行性疾病相關,可能通過調節β-淀粉樣蛋白代謝影響疲勞。
GPX1:作為抗氧化酶,在氧化應激狀態下表達增加,清除自由基以維持神經元功能。
SNF8:參與自噬功能,突變可能導致能量代謝異常。
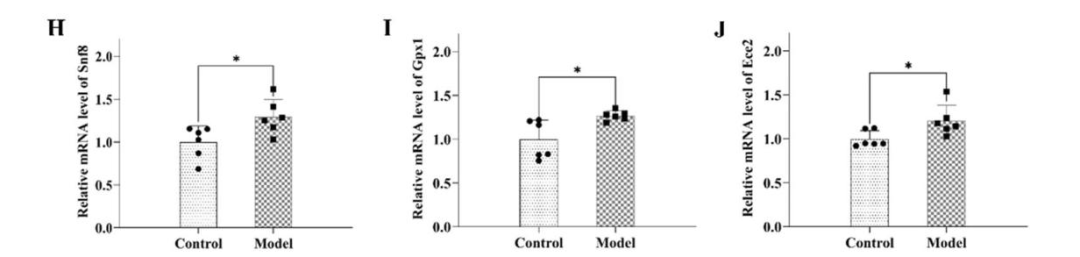
中樞疲勞大鼠模型額葉皮質中Snf8、Gpx1和Ece2相對表達水平顯著升高
能量成本與獎勵評估系統
疲勞源于能量消耗與獎勵的失衡。腦島監測生理狀態(如血糖水平),ACC整合腦島、OFC和杏仁核的信息,判斷是否繼續投入能量。當能量成本超過獎勵時,多巴胺活性下降,動機減弱,引發主觀疲勞感。例如,長時間工作后,OFC對獎勵的估值降低,而腦島信號增強,最終ACC判定“不值得努力”,則產生疲勞感。
HUIYING
tDCS緩解疲勞的神經機制
靶向調節前額葉皮層
tDCS通過陽極刺激背外側前額葉(DLPFC,F3區域),增強神經元興奮性。2 mA電流持續30分鐘可提升警覺性任務表現,效果持續6小時以上。其原理包括:
抑制腺苷積累:疲勞時腦內腺苷水平升高,阻斷多巴胺釋放。tDCS可能通過調節腺苷A1受體,減少其抑制作用。
增強多巴胺傳遞:刺激DLPFC間接激活中腦多巴胺通路,提升伏隔核和ACC的多巴胺水平,增強動機。
神經可塑性與持續效應
tDCS的長期效果(>6小時)源于突觸可塑性變化,類似長時程增強(LTP)。30分鐘刺激可誘導膠質細胞釋放神經遞質,維持神經元興奮性。此外,tDCS改善資源理論相關的認知資源損耗,而非僅提升覺醒水平,因此對抗疲勞效果更顯著。
HUIYING
臨床研究驗證:tDCS vs咖啡因
研究方法
實驗研究對象為30名軍人,分為三組:
tDCS組:30分鐘2 mA陽極刺激+安慰劑口香糖。
咖啡因組:200 mg咖啡因口香糖+假刺激。
對照組:假刺激+安慰劑。
實驗在30小時持續清醒后進行,在04:00接受不同處理(tDCS +安慰劑口香糖、假tDCS +安慰劑口香糖、咖啡因口香糖+假tDCS),期間定時進行任務和問卷評估(評估警覺性、工作記憶和主觀疲勞)。
研究結果
警覺性任務(Mackworth時鐘測試):tDCS組準確性顯著高于假刺激組和咖啡因組,且在04:00、08:00表現更優。
工作記憶任務(DMS):咖啡因組和tDCS組反應時均優于假刺激組,但組間差異不顯著,且對分數/準確性無明顯影響。
心理運動任務(PVT):咖啡因組和tDCS組平均反應時均優于假刺激組,組間無顯著差異,對其他心理運動指標無影響。
主觀疲勞問卷:tDCS組在困倦、精力等方面主觀感受優于假刺激組,在疲勞、綜合情緒等方面也有優勢,且tDCS組準確性變化與主觀情緒無關,而咖啡因組和假刺激組相關。
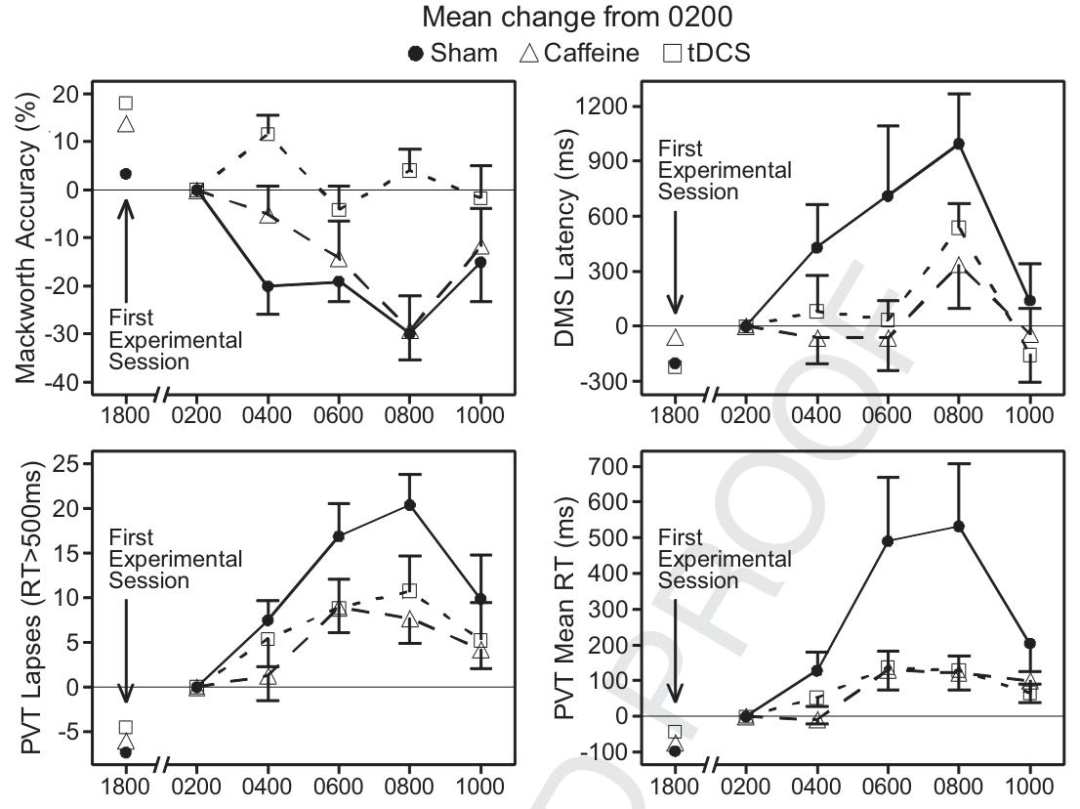
各性能任務相對于凌晨2點(基線)的平均變化情況
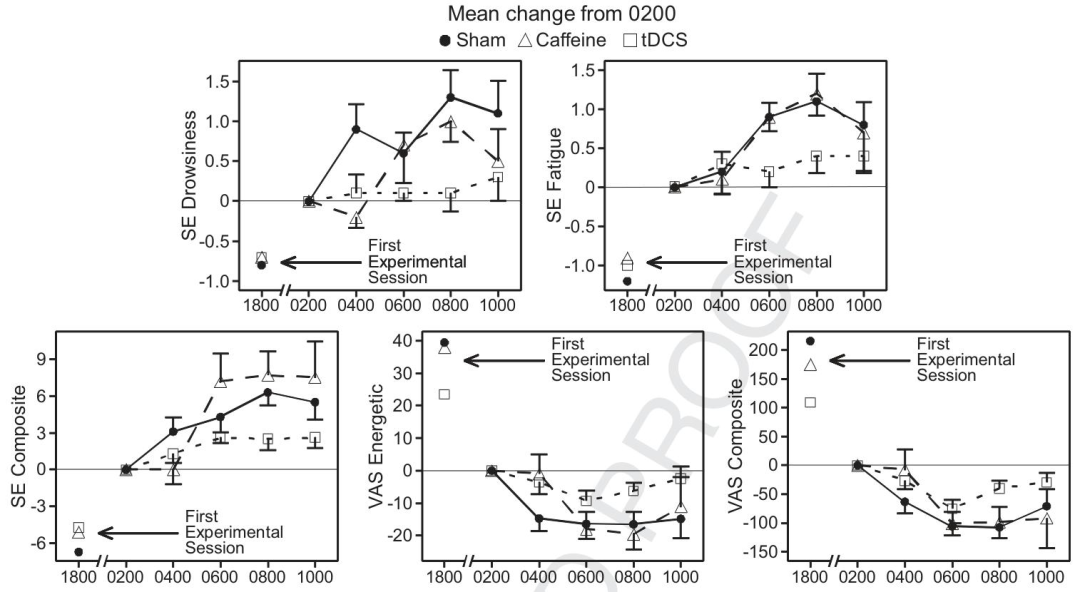
疲勞主觀測量值相對于凌晨2點(基線)的平均變化情況
副作用與適用性
tDCS組僅報告輕微頭皮刺痛,而咖啡因可能引發焦慮和心率升高。長期使用咖啡因效果遞減,而tDCS無耐受性報告。
研究結論
tDCS在提高警覺性方面比咖啡因更有效,效果持續至少6小時,且能改善情緒,減少疲勞和困倦感。兩者對工作記憶和心理運動表現的影響相似。tDCS或可作為抗疲勞的有效替代方法,但長期使用效果和更高劑量的影響有待進一步研究。
HUIYING
tDCS治療參數
參數類別 | 設置詳情 |
陽極 | F3(10-20 EEG系統定位) |
陰極 | 對側右三角肌(減少皮層外效應) |
電極陣列 | 5個銀/氯化銀EEG電極 |
成人tDCS | 電流:1-2 mA,時間:20分鐘,頻率:每日按需 |
青少年tDCS | 電流:0.5-1 mA,時間:20分鐘,頻率:每日按需 |
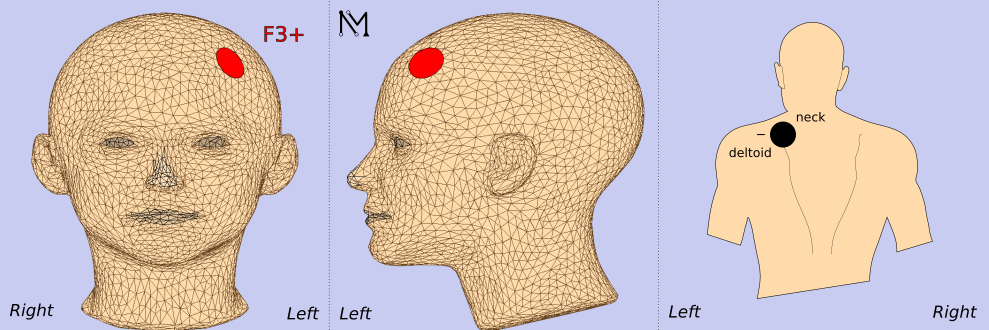
電極位置示意圖
安全性與禁忌癥:癲癇史、顱內金屬植入物、皮膚損傷。
總結
tDCS通過靶向前額葉皮層,調節多巴胺和腺苷系統,顯著改善警覺性和主觀疲勞感,且效果持久。結合基因研究發現,未來可針對ECE2、GPX1等靶點開發個性化干預方案。這一方案為軍事、醫療等高疲勞風險職業提供了新的應對策略。
HUIYING
回映產品
1.便攜式HD-tES
回映便攜式高精度經顱電刺激儀(HD-tES)創新地采用type-C轉生物電極的設計使得產品能夠非常便捷地被使用。回映便攜式高精度經顱電刺激儀(HD-tES)通過多電極配置(1個中心電極和4個返回電極)實現高精度電流聚焦,精準刺激目標腦區。其核心優勢在于通過縮小電極尺寸(直徑12mm的環形電極)和增加電極數量,顯著提升刺激的聚焦性和精準性。
HD-tDCS模式:調節皮層興奮性,適用于中風康復、抑郁癥干預等。
HD-tACS模式:精準鎖定腦電頻段(如β-γ頻段改善強迫癥,4Hz增強工作記憶)適配認知障礙治療等。
HD-tRNS模式:HD-tRNS 對顯式和隱式計時任務的影響不同,用于研究大腦的計時機制和時間處理能力等。
適用范圍:神經系統疾病治療,意識障礙和認知功能調節,康復治療,運動和認知功能恢復。

回映自研type-C轉生物電極示意圖
基本參數
刺激強度:-2mA~2mA 連續可調,調節分辨率0.01mA,輸出電流誤差 <=±10%;
刺激時間:0~60min 可調;
刺激頻率:針對于 tPCS/tACS 模式,1Hz ~ 99Hz范圍內可調,頻率步進1Hz, 輸出頻率誤差<=±5%;
淡入淡出時間:0~120s 可調,確保刺激的安全性;
脫落檢測:通過實時阻抗檢測分析電極脫落狀態確保刺激有效性;
相位同步:<=±2.5us; <=0.09°;
2.手持式tES
經顱電刺激調控設備采用低強度的電流(±2mA以內)對大腦皮層的靶區域進行刺激,進而達到調節大腦皮層神經元興奮性、調節腦電波節律、促進神經重塑和修復、改善腦部供血等。
經顱直流電刺激(tDCS):治療精神分裂癥、抑郁癥、物質成癮、阿爾茨海默病、腦卒中后的運動功能障礙、語言障礙、認知障礙等
經顱交流電刺激(tACS ):治療視功能障礙、認知障礙,提高學習能力、工作記憶等
經顱脈沖電刺激(tPCS):增強運動技能,緩解疲勞,促進知覺學習任務、算術任務,調節注意力切換任務的準確性,改善帕金森病患者的步態平衡等
經顱隨機噪聲刺激(tRNS):治療耳鳴,提高工作記憶、認知能力等
適應癥:焦慮、抑郁、失眠、癲癇、強迫癥、注意缺陷多動障礙、鞏固記憶、運動控制等。

回映便攜式tES設備示意圖
基本參數
刺激強度:10mA~30mA 連續可調,調節分辨率0.01mA,輸出電流誤差<=±10%
刺激頻率:1Hz~99Hz 范圍內可調,頻率步進為 1Hz,輸出頻率誤差 <=±5%
載波頻率:2KHz~100KHz 范圍內可調,頻率步進為 1KHz,輸出頻率誤差 <=±1%
刺激時間:0~60min可調
淡入淡出時間:0~120s 可調,確保刺激的安全性
脫落檢測:通過實時阻抗檢測分析電極脫落狀態確保刺激有效性
參考文獻
1.Mapping fatigue: discovering brain regions and genes linked to fatigue susceptibility(作者Yifei Zhang, Zehan Zhang, Qingqian Yu, Yutong Jiang, Chenyu Fei, Fengzhi Wu and Feng Li)
2.Mental fatigue: Costs and benefits(Maarten A.S. Boksem,b,d,, Mattie Topse)
3.A Comparison of the Effects of Transcranial Direct Current Stimulation and Caffeine on Vigilance and Cognitive Performance During Extended Wakefulness(Lindsey K. McIntire a, R. Andy McKinley b, Chuck Goodyear a, Justin Nelson a)
-
醫療電子
+關注
關注
30文章
1381瀏覽量
91256 -
電刺激裝置
+關注
關注
0文章
20瀏覽量
5682
發布評論請先 登錄
美國試驗將“經顱直流電刺激”(TDCS)技術的用途從促進受傷士兵恢復
經顱直流電刺激對孤獨癥譜系障礙兒童腦電的研究
經顱電刺激適應癥系列之tACS調節睡眠

研發閉環經顱超聲神經刺激——變形皮質粘附傳感器

經顱電刺激適應癥之tDCS治療注意力缺陷ADHD

經顱電刺激適應癥系列之tDCS提高數學能力

經顱電刺激系列之相移經顱交流電刺激Phase-shifted tACS






 經顱電刺激適應癥系列之tDCS對抗疲勞
經顱電刺激適應癥系列之tDCS對抗疲勞












評論