CAR-T療法
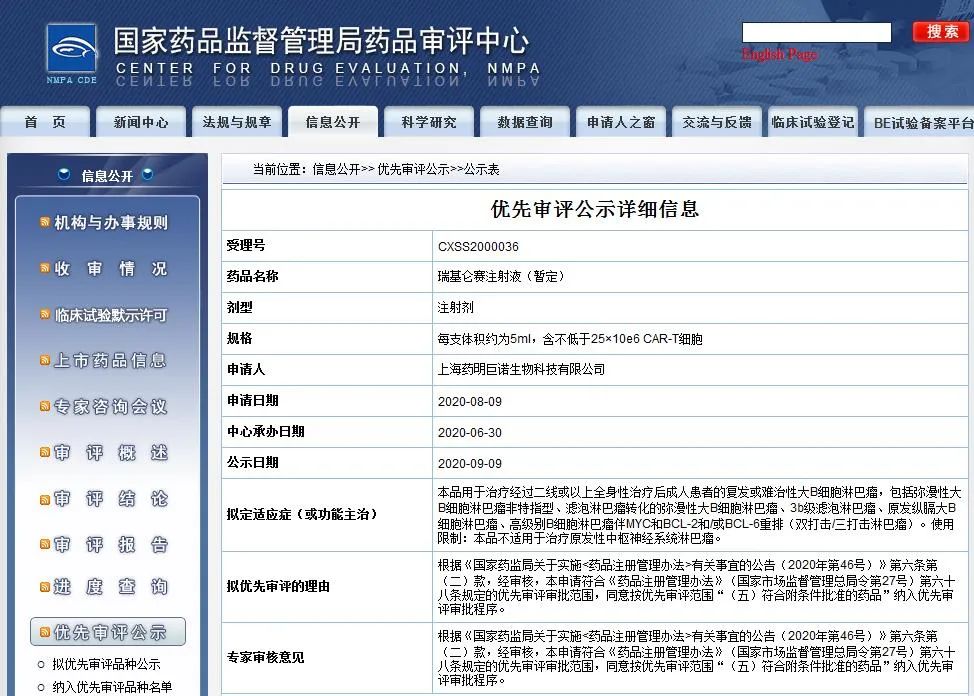
9月9日,中國國家藥監(jiān)局藥審中心(CDE)最新公示,藥明巨諾的瑞基侖賽注射液(暫定名,研發(fā)代碼為JWCAR029,通用名為“CD19靶向嵌合抗原受體T細胞”)上市申請擬被納入優(yōu)先審評,理由是“符合附條件批準的藥品”。
根據(jù)CDE發(fā)布的信息,JWCAR029上市申請擬定適應(yīng)癥為治療經(jīng)過二線或以上全身性治療后成人患者的復(fù)發(fā)或難治性大B細胞淋巴瘤,包括彌漫性大B細胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)非特指型、濾泡淋巴瘤轉(zhuǎn)化的彌漫性大B細胞淋巴瘤、3b級濾泡淋巴瘤、原發(fā)縱膈大B細胞淋巴瘤、高級別B細胞淋巴瘤伴MYC和BCL-2和/或BCL-6重排(雙打擊/三打擊淋巴瘤),不適用于治療原發(fā)性中樞神經(jīng)系統(tǒng)淋巴瘤。
值得關(guān)注的是
JWCAR029還擬被納入突破性治療品種名單。由此,JWCAR029成為了國內(nèi)首個同時獲得擬優(yōu)先審評和擬突破性藥物品種“雙重審評資格”的1類創(chuàng)新藥。

根據(jù)此前國家藥監(jiān)局發(fā)布的《突破性治療藥物審評工作程序(試行)》文件,突破性治療藥物適用于藥物臨床試驗期間,用于防治嚴重危及生命或者嚴重影響生存質(zhì)量的疾病且尚無有效防治手段或者與現(xiàn)有治療手段相比有足夠證據(jù)表明具有明顯臨床優(yōu)勢的創(chuàng)新藥或者改良型新藥等,并要求在I、II期臨床試驗階段,通常不晚于III期臨床試驗開展前申請。
據(jù)了解,JWCAR029是在美國朱諾(Juno)公司CAR-T療法的JCAR017基礎(chǔ)上,由藥明巨諾自主開發(fā)的CAR-T產(chǎn)品。2017年12月,藥明巨諾通過明聚生物遞交JWCAR029的新藥臨床試驗(IND)申請,并于2018年6月獲得批準。
2019年12月,在第61屆美國血液病學(xué)會(ASH)年會上,藥明巨諾公布了JWCAR029治療成人復(fù)發(fā)/難治B細胞非霍奇金淋巴瘤(R/R B-NHL)的I期臨床試驗數(shù)據(jù),在入組的32個病人、4個爬坡劑量的I期研究中,JWCAR029顯示了良好的安全性和有效性。
對于預(yù)后較差的R/R侵襲性B-NHL患者,輸注JWCAR029可獲得優(yōu)異且持久的緩解,6個月時所有患者(n=29)的客觀緩解率(ORR)為58.6%,完全緩解率(CR)為55.2%;對所有回輸劑量的DLBCL患者:ORR為45%,CR率為45%。安全性方面,JWCAR029毒性可控,未發(fā)生細胞因子釋放綜合征(CRS)或神經(jīng)毒性(neurotoxicity,NT)相關(guān)性死亡,3/4級CRS或NT發(fā)生率低,約為6% (n=32)。
今年7月,藥明巨諾向中國國家藥監(jiān)局遞交了JWCAR029的上市申請,這是繼復(fù)星凱特申報的益基利侖賽注射液(國外商品名為Yescarta)之后國內(nèi)第二個遞交上市申請的CAR-T療法。不同于益利侖賽已在國外上市,瑞基侖賽為全球首次申報上市。
伴隨著產(chǎn)品上市進程的不斷加快,藥明巨諾也正式開啟了赴港上市之旅,公司已正式向港交所提交了IPO申請書,其將擬募資2-3億美元(約合人民幣13.8-20.7億元),用于產(chǎn)品研發(fā)、新潛在收購及引進授權(quán)機會、公司運營及一般公司用途。其中,圍繞JWCAR029的研發(fā)、未來中國市場的銷售及其他候選產(chǎn)品的研發(fā)活動將是該公司重點布局的方向。
-
細胞
+關(guān)注
關(guān)注
0文章
67瀏覽量
18461 -
治療
+關(guān)注
關(guān)注
0文章
6瀏覽量
9303
發(fā)布評論請先 登錄
洲明科技榮膺“中國上市公司2024年度投資者關(guān)系管理最佳實踐”獎項
維信諾主導(dǎo)的有機電子器件國家標準獲批立項
國巨電容的優(yōu)勢在哪?揭秘其厚膜電容的技術(shù)亮點!

寧德時代正式遞交港股上市申請
寧德時代本周提交港股上市申請
英諾賽科港股上市!盈利能力逐年上升,估值超234億元
小馬智行獲粵港澳大灣區(qū)智能網(wǎng)聯(lián)汽車示范應(yīng)用試點互認資格
立訊精密獲上市公司權(quán)威獎項
數(shù)據(jù)智能應(yīng)用軟件公司明略科技遞表港交所
易弗明獲小米集團戰(zhàn)略投資
數(shù)藥智能:數(shù)字療法成為多動癥治療新方向

人工智能公司諾比侃向港交所遞交上市申請
產(chǎn)品申請北美運營商AT T認證的優(yōu)勢有哪些






 藥明巨諾CAR-T療法的上市申請獲雙重審評資格
藥明巨諾CAR-T療法的上市申請獲雙重審評資格










評論