近年來,軟生物電子技術迎來了蓬勃發展的時代,因為它在個性化醫療監測、護理點臨床診斷、假肢和人機界面等方面的應用前景廣闊,將從根本上提高精確治療學的效率,并改變人與機器的交互方式:(1)柔軟、靈敏,可感知環境刺激的微小變化,如應變(0.1%)和壓力(0.1%);(2)柔韌、可拉伸(~1000%),可順應性地附著于任何彎曲表面,如人體皮膚;(3)薄(~1 um)、輕(3 g/m2),可實現難以察覺的集成和隨時移動。這些突出特點使軟生物電子器件能夠與人體和假肢無縫集成,實現對各種物理和生物信息的實時、長期和低成本傳感。迄今為止,已開發出多種軟生物電子器件,包括電子皮膚、穿戴式傳感器、柔性摩擦納米發電機(TENGs)、軟超級電容器和植入式電子器件。其應用范圍很廣,從觸覺傳感、重要生理信號監測、生物標志物檢測(如汗液、淚液和尿液)到體內給藥、細胞操作以及神經調控和治療。傳統器件無法實現的卓越功能已成功實現。例如,無電池表皮電子元件可用于無線、連續和實時測量脆弱新生兒的心電圖(ECG)和光敏血壓計(PPG)信號,與傳統的硬連線監測系統相比,可大大減少對新生兒皮膚的傷害和對嬰兒自然活動的限制。目前已發明了可植入的類組織電子元件,可與神經組織適形連接,通過電刺激實現局部神經調控。
盡管軟生物電子學正在為人類生活和社會帶來快速變革,但目前開發的生物電子學大多基于紡織品等具有較大楊氏模量(通常為2 Mpa ~ 1 GPa)和非內在生物相容性的材料,與人體皮膚或組織的機械不匹配以及嚴重的生物相容性問題極大地阻礙了它們在生物醫學領域的實際應用。與這些材料相比,水凝膠是一種滲入大量水分(80 wt%)的三維聚合物網絡,因其具有模擬組織的楊氏模量、優異的生物相容性與生物相似的離子導電性和多種刺激響應性,已被廣泛認為是開發生物醫學應用領域軟性穿戴式和植入式電子器件的理想材料。具體來說,水凝膠的楊氏模量(~1 Pa至~1 MPa)與人體皮膚或組織的楊氏模量(~1 kPa至~100 kPa)接近,可使電子組織界面具有極佳的機械匹配性,有助于實現電子與生物的順應性集成。其優越的細胞外基質仿生結構使軟生物電子器件具有類似原生組織的生理特性,即良好的細胞相容性和組織相容性可避免在長期附著過程中出現意外的生物免疫反應。同時,水凝膠的離子傳導機制使電子器件能夠與生物組織進行便捷的電交流。因此,水凝膠電子器件可以在機械、電學和生物化學特性等各個方面完美地彌補人類與機器之間的差距,并實現下一代軟生物電子學的開發。迄今為止,已開發出多種基于水凝膠的軟生物電子器件,包括傳感器、顯示器、TENGs和植入式電極,可用于皮膚和植入式應用。
盡管水凝膠在開發穿戴式和植入式生物電子器件方面前景廣闊,但在臨床過渡和實際應用之前,仍存在一些挑戰性問題,需要加以解決。其中一個關鍵挑戰是,由于水凝膠固有的楊氏模量較低,加上人體內復雜的承載和動態環境,水凝膠生物電子器件在使用過程中很容易損壞,這嚴重阻礙了其長期可靠的應用。例如,穿戴式電子器件不可避免地會受到來自外部環境的各種機械力的影響,如劃痕、磨損、撕裂和穿刺。在人體器官和關節頻繁而持續的運動過程中,如心臟的持續收縮和擴張,植入式生物電子器件可能會受到超范圍拉伸、應力疲勞和應力引起的內部微裂縫的破壞。
人的皮膚是一種復雜的感官系統,在受損時可以再生或修復,因此可以工作一百多年。受此啟發,研究人員致力于賦予水凝膠生物電子“自再生”或自修復“能力,以延長其耐用性、可靠性和壽命。自愈能力在軟生物電子學中發揮著重要作用,因為它可以從根本上克服軟生物電子學在運行過程中不可避免的結構斷裂和功能失效或退化。其基本機理是,具有自愈合能力的水凝膠(SHHs)能夠在受損后重建斷裂的鍵,從而恢復其原有的機械、化學和電子特性。這種能力賦予了水凝膠軟生物電子學幾種顯著的功能:(1)使軟生物電子器件在受到破壞后能夠恢復其原有的結構、功能和性能;(2)通過應力消散效應提高器件的機械耐久性,以實現長期應用,當受到負載時,自愈合水凝膠中的可逆動態鍵可作為犧牲鍵斷裂并消散累積的應力和能量,從而減輕應力集中和對結構的破壞。當載荷移除時,斷裂的可逆鍵可以重塑,恢復受損水凝膠的原始結構和機械性能,從而抵御應力引起的裂縫和應力疲勞,提高器件的機械耐久性。(3)賦予軟生物電子器件形狀適應能力,即通過自愈合水凝膠中可逆鏈接的斷裂和重構,使其結構適應各種組織或器官形狀。
近期,Advanced Materials期刊發表了題為“Self-healing Hydrogel Bioelectronics”的綜述,討論了自愈合水凝膠的最新進展,從水凝膠材料的自愈合機理、材料化學和多種性能改進策略,到各種基于水凝膠的生物電子器件的設計、制造和應用,包括穿戴式物理和生化傳感器、超級電容器、柔性顯示器件、摩擦納米發電機(TENGs)、植入式生物電子器件等。此外,還提出了阻礙自愈合水凝膠生物電子學發展的持續挑戰及其前景。該綜述有望加快自愈合水凝膠在各種自愈合生物電子學中的研究和應用。香港大學張世明教授及西安交通大學趙立波教授、西北工業大學薛語萌教授為共同通訊作者。
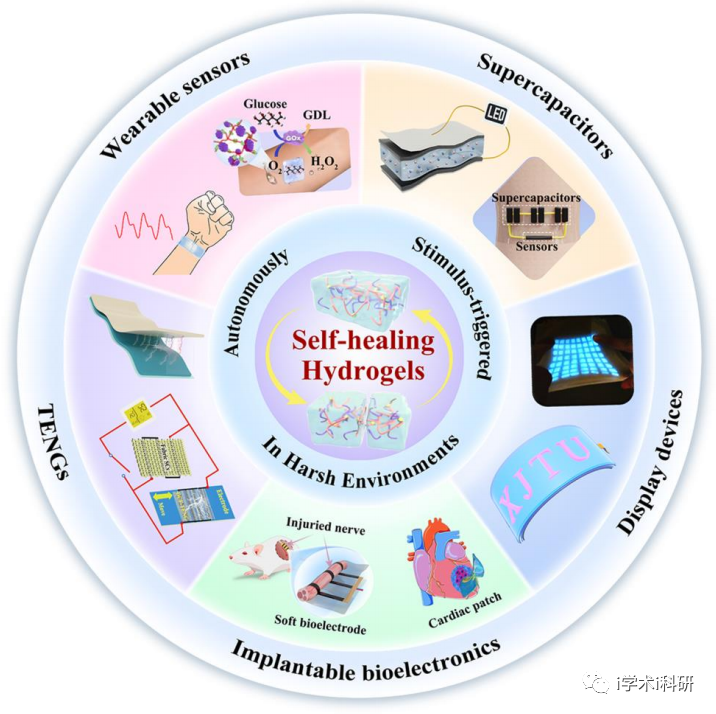
自愈合水凝膠的原理圖及其在軟生物電子學中的潛在應用
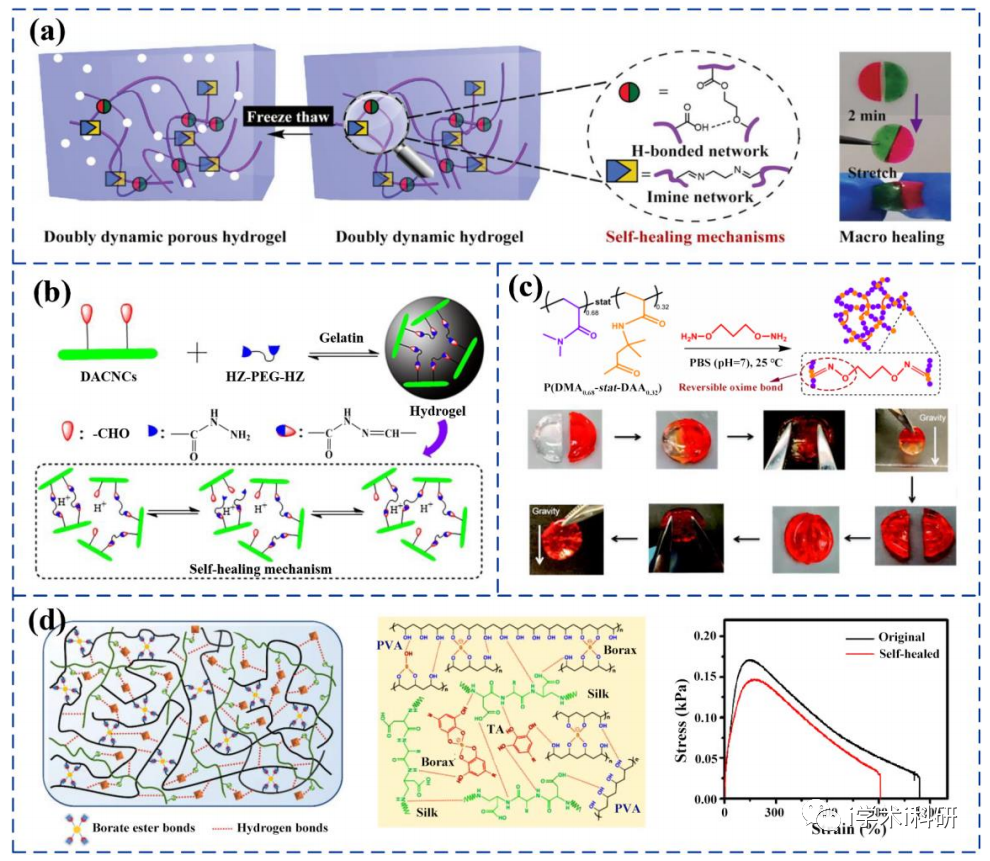
基于動態共價鍵相互作用的自愈合水凝膠
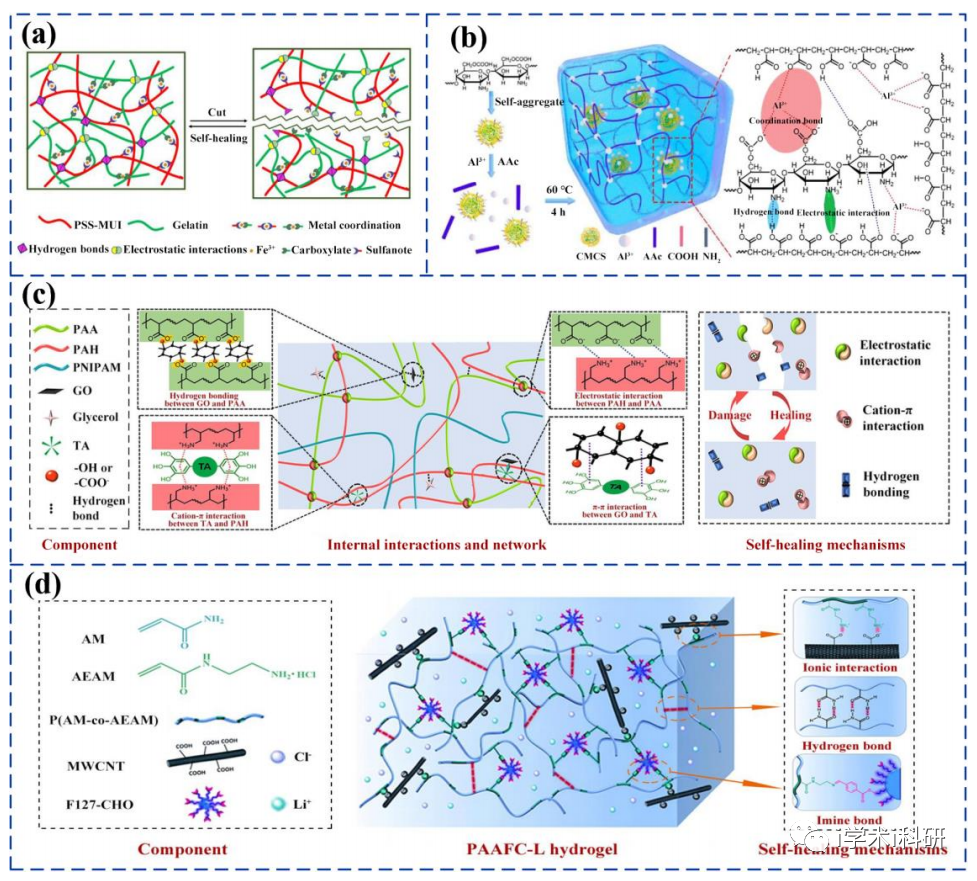
基于多種協同性相互作用的自愈合水凝膠
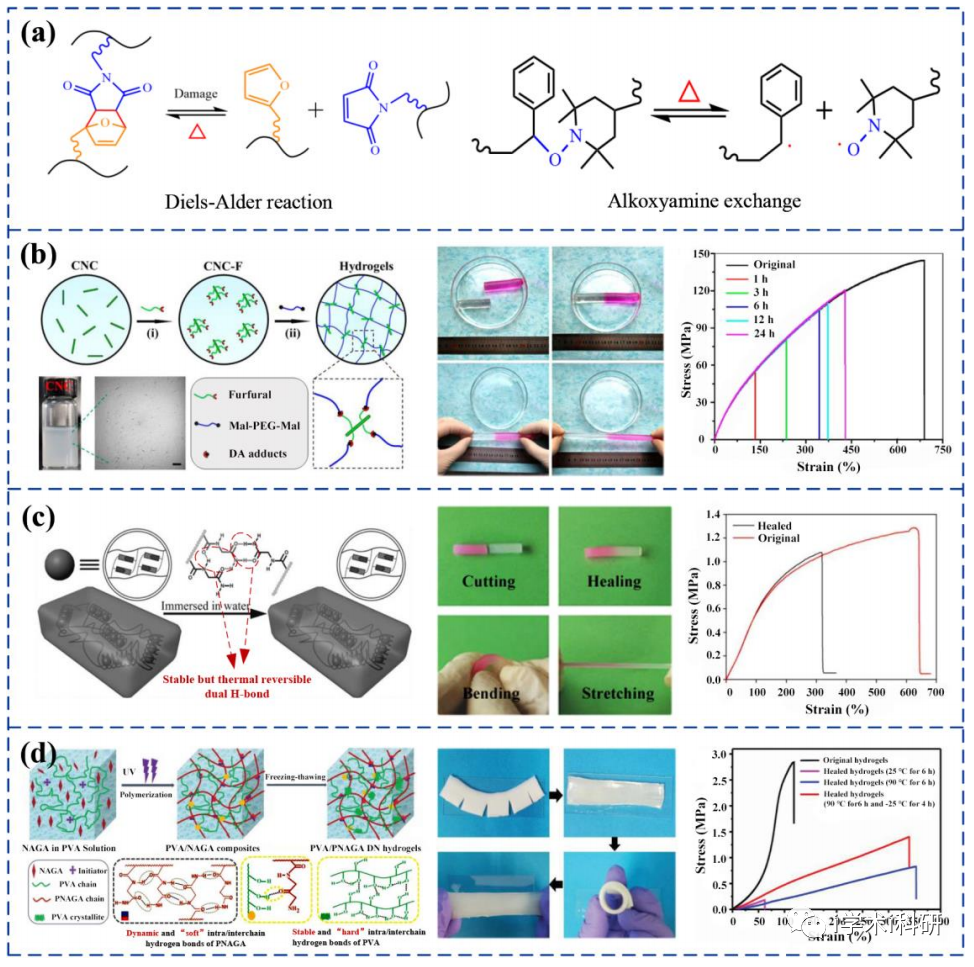
熱觸發自愈機制及制備的自愈合水凝膠
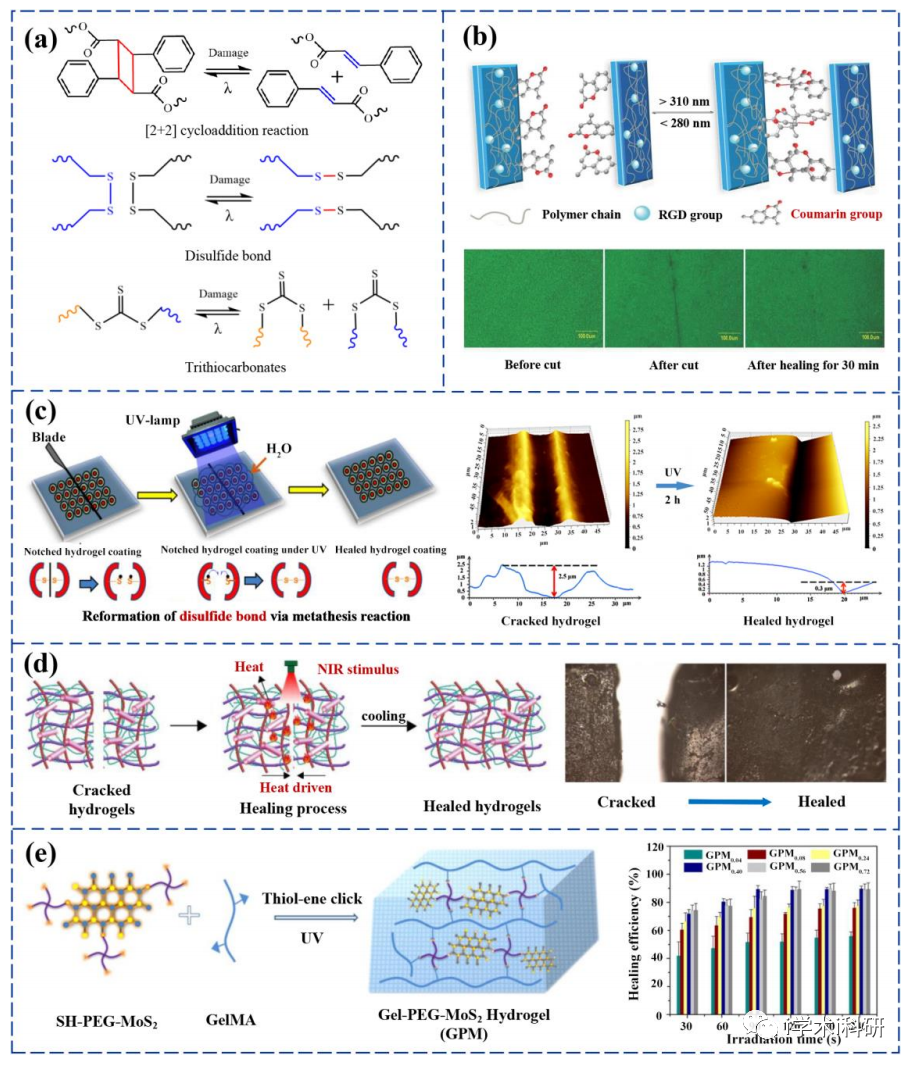
光觸發自愈機制及制備的自愈合水凝膠
在這篇綜述中,作者重點介紹了過去幾年在合成自愈合水凝膠及其應用于開發軟生物電子學方面所探索的最突出機制。目前已構建出多種自愈機制,涉及自主和外部刺激響應特性。利用這些機制,許多自愈合水凝膠得到了證實,它們在自愈率、恢復速度、允許的自愈周期以及許多其他理化性能(如機械強度、伸展性、導電性、抗凍能力、保水性能等)方面都有顯著改善。這些自愈合水凝膠的應用范圍很廣,從穿戴式傳感器、光學顯示器、超級電容器和TENG到植入式生物電子器件。機械損傷后出色的性能恢復能力已得到證實,從而大大提高了軟電子器件的可重復使用性和使用壽命。盡管已經取得了巨大進步但大多數已開發的自修復電子器件仍處于概念驗證階段。在最終的工程應用之前,還需要應對巨大的挑戰。
(1)深入了解自愈合理論和性能評估。目前,大多數研究工作都集中在探索水凝膠可能的自愈合機制,并通過實驗證明其宏觀自愈合行為。目前還缺乏分子層面的自愈合動力學理論分析或建模,無法說明分子的類型、動力學和濃度以及環境參數(如溫度、pH 值等)對動態鍵的形成以及鍵能的影響。建立理論模型,從分子成分定量計算水凝膠的自愈合宏觀性能(例如自愈合效率、時間和周期)是可取的。這些模型不僅能預測給定條件下的自愈合性能,還能在機器學習和人工智能的幫助下提供強大的設計策略,以滿足目標容量要求。此外,構建性能評估標準和相應的實驗表征方法也將有助于直接定量表征和驗證水凝膠的自愈合性能。
(2)同時提高自愈合能力和其他所需的材料性能。在軟電子器件的實際應用中,水凝膠不僅要具備自愈合能力,還要具備許多其他必要的性能,如機械強度、拉伸性、導電性等。然而,由于這些性能對材料組件設計的要求相互矛盾,因此在同時提高這些性能方面存在巨大挑戰。一個常見的挑戰是如何權衡自愈合水凝膠與機械性能(楊模量)之間的關系。具有高自愈合能力的水凝膠在環境溫度下很少有足夠的楊氏模量。這是因為高楊氏模量需要快速的段和鏈動力學以及易于斷裂/交換的動態鍵,而這通常是以低模量和弱動態鍵的聚合物鏈為代價的。探索新策略來平衡包括自愈能力在內的多種功能之間的矛盾,對于實現水凝膠的實際工程應用至關重要。一個有前景的解決方案是利用結合了不同動態鍵的復雜分子設計和具有特定形態的網絡結構。
(3)賦予自愈合水凝膠環境適應能力。由于水凝膠具有富水和親水性,因此在環境溫度或更高溫度下容易脫水,在低溫下容易凍結,在水中容易膨脹。這些因素會降低水凝膠電子器件的穩定性和可靠性,甚至導致器件失效。在確保自愈合性能的前提下,解決失水、凍結和膨脹問題對自愈合水凝膠電子器件至關重要,這可以提高器件的穩定性和可靠性,擴大其應用范圍,如在低溫、水下等環境下。此外,具有可控降解性的自愈合水凝膠在開發環境友好型植入式自愈合軟器件方面也大有可為。
(4)開發具有完全自愈能力的軟電子器件。盡管過去幾年中已經展示了多種自愈合軟電子器件但很少有器件能實現整體自愈合,尤其是那些具有多層或多層結構元件的器件,如電容式傳感器。要實現完整的自愈合水凝膠電子器件,器件結構的每個元件層都應具備自愈合能力。也就是說,除了水凝膠外,器件結構所需的許多其他材料也應具有自愈合能力。此外,由于自愈合性能(速度、重復周期和條件)的不匹配,在器件愈合過程中克服功能失效引起的變形、剝離和錯位更具挑戰性。針對這一問題,應大力構建有效的策略。此外,不同層之間的界面粘附/粘合和界面自愈也有助于保持器件結構的穩健性,并在損壞后實現全面的性能恢復。
(5)探索自愈合水凝膠電子器件的制造技術。制造技術是開發自愈合水凝膠電子器件的關鍵。它彌補了器件概念與實際應用之間的差距。目前,大多數基于自愈合水凝膠的電子器件都是用結構設計簡單的塊狀自愈合水凝膠制造的,而且圖案化和集成都是人工進行的。當務之急是探索能實現圖形圖案化、器件間一致性和集成制造的制造技術。在這方面,3D/4D打印、軟光刻、絲網印刷、直接墨水書寫和噴墨打印在制造具有復雜結構和一致性能的自修復水凝膠電子器件方面具有巨大潛力。此外,微型化和可擴展制造可縮小器件尺寸,實現高密度集成(使單個器件具有多種功能),并降低成本,而這正是自愈合軟電子器件所急需的。制造具有微/納米厚度和良好透氣性的自愈合水凝膠器件可提高用戶長期使用的舒適度。
(6)賦予自愈合水凝膠生物電子學新功能,實現更廣泛和革命性的應用。隨著基于自愈合水凝膠的柔性電子技術深入人類生活,需要不斷賦予其新的革命性功能,以拓展應用范圍,創新現有應用方式。例如,具有形狀記憶功能的自愈合水凝膠生物電子器件可以記憶復雜的形狀并在外部刺激下以可編程的方式恢復到初始形狀,可廣泛應用于微創手術、生物醫學器件和智能軟生物致動器等需要器件結構和性能具有可控激活能力的場合。自愈合水凝膠電子器件具有形狀可編輯和自粘附能力,可以保形粘附在所需形狀的組織或復雜器官表面,實現長期生理信息監測,并進一步應用于人工神經、腦機接口和腦疾病治療。此外,自愈合水凝膠電子器件還可以與自愈合超級電容器和自愈合TENGs集成,實現自供電,從而實現連續運行。例如,集成的自愈式穿戴式傳感器可實現連續、長期、穿戴式的醫療監測,而這正是柔性電子技術發展的最終目標。
一旦攻克了這些關鍵難題,通過合理地結合多種自修復機制和拓撲結構設計,將有望構建出具有卓越綜合性能的自修復水凝膠。自愈合水凝膠生物電子器件將能在成千上萬次的損傷下完全恢復其性能,并同時具備許多其他優異性能,如足夠的機械強度、高拉伸性、優異的導電性、理想的穩定性和可靠性等。隨著自愈合水凝膠生物電子學的快速發展,其在穿戴式生理信號監測、體內給藥、組織工程支架、人體器官電生理信號傳感、傷口包扎、隱形眼鏡、神經信號記錄與調控、重大神經疾病治療等領域均已實現臨床轉化或商業化。可以預見,在不久的將來,自愈合水凝膠生物電子學將融入人類的日常生活,使人們的生活方式發生革命性的變化。
-
電子器件
+關注
關注
2文章
602瀏覽量
32610 -
水凝膠
+關注
關注
0文章
26瀏覽量
9189 -
觸覺傳感
+關注
關注
0文章
13瀏覽量
8284
原文標題:綜述:自愈合水凝膠生物電子器件研究進展
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
電機控制器電子器件可靠性研究
香港科技大學陳敬課題組揭示GaN與SiC材料的最新研究進展

碳基射頻電子器件的研究進展

CBM24AD99Q | 重塑生物電勢測量,開啟精準醫療新時代

同濟大學:研究基于雙極性駐極體的全生物可降解、高靈敏度壓力傳感器及體內/外生物力學信號監測應用
AI大模型的最新研究進展
生物電信號的主要的基本有哪些
電壓驅動的電力電子器件有哪些
導熱紙(膜)的研究進展 | 晟鵬技術突破導熱芳綸紙






 綜述:自愈合水凝膠生物電子器件研究進展
綜述:自愈合水凝膠生物電子器件研究進展











評論