01 什么是CRISPR?

基因攜帶著生物體的遺傳信息,是儲(chǔ)存著生命的種族、血型、孕育、生長(zhǎng)、凋亡等過(guò)程的一套精確的密碼,決定了生物體的性狀。
隨著科學(xué)研究的深入,某些場(chǎng)景我們需要人為改變這些密碼,調(diào)控生物體的各種性狀,諸如性別、毛色、膚色等等(當(dāng)然性狀也受環(huán)境的影響),這種行為被稱(chēng)為基因編輯。然而基因編輯并非易事,原因之一便是基因眾多,組成簡(jiǎn)單生命最少要 265 到 350 個(gè)基因。這些基因上沒(méi)有標(biāo)簽,無(wú)從知道哪段基因?qū)?yīng)了什么性狀。而且基因存在于微小的 DNA 中,尺度在納米級(jí)別。微小而繁復(fù),使得基因編輯就像是在一團(tuán)亂麻中找到想編輯的一段進(jìn)行微型手術(shù),難度不言而喻。
而在1987年被科學(xué)家在大腸桿菌中發(fā)現(xiàn)的一段“無(wú)法確定功能”的DNA成為了基因編輯技術(shù)的一大契機(jī),這段DNA后期被稱(chēng)為CRISPR。CRISPR是生命進(jìn)化歷史上,細(xì)菌和病毒進(jìn)行斗爭(zhēng)產(chǎn)生的免疫武器,簡(jiǎn)單說(shuō)就是病毒能把自己的基因整合到細(xì)菌,利用細(xì)菌的細(xì)胞工具為自己的基因復(fù)制服務(wù),細(xì)菌為了將病毒的外來(lái)入侵基因清除,進(jìn)化出 CRISPR-Cas9 系統(tǒng),利用這個(gè)系統(tǒng),細(xì)菌可以不動(dòng)聲色地把病毒基因從自己的基因組上敲除,這是細(xì)菌特有的免疫系統(tǒng),是古菌和細(xì)菌抵抗病毒等外源遺傳物質(zhì)入侵的一種獲得性免疫系統(tǒng)。微生物學(xué)家掌握了細(xì)菌擁有多種切除外來(lái)病毒基因的免疫功能,其中比較典型的模式是依靠一個(gè)復(fù)合物,該復(fù)合物能在一段RNA指導(dǎo)下,定向?qū)ふ夷繕?biāo)DNA序列,然后將該序列進(jìn)行敲除。許多細(xì)菌免疫復(fù)合物都相對(duì)復(fù)雜,其中科學(xué)家掌握了對(duì)一種蛋白Cas的操作技術(shù),并先后對(duì)多種目標(biāo)細(xì)胞DNA進(jìn)行敲除。
通俗地說(shuō),CRISPR 技術(shù)是一種基因敲除(基因編輯)的技術(shù)。這種技術(shù)無(wú)視基因帶來(lái)的挑戰(zhàn),它的強(qiáng)大之處在于能夠?qū)崿F(xiàn)精確的基因編輯,達(dá)到指哪打哪的程度,實(shí)現(xiàn)更高效率的基因敲除。在過(guò)去的十年里,圍繞著 CRISPR 技術(shù)的研究數(shù)量發(fā)生了爆炸式增長(zhǎng)。這些研究帶來(lái)了諸多富有創(chuàng)新性的應(yīng)用,比如使用 CRISPR 技術(shù)對(duì) DNA 納米結(jié)構(gòu)進(jìn)行工程化設(shè)計(jì)或是通過(guò)基因編輯來(lái)治療遺傳疾病(例如鐮狀細(xì)胞病),這些突破性研究極大地革新了傳統(tǒng)基因編輯技術(shù)。
02 CELESTA光源用于 CRaft-ID 成像
 混合基因敲除篩選(Pooled genetic knockout screens)在功能基因組學(xué)界廣泛用于鑒定與細(xì)胞表型相關(guān)的基因,而基因敲除方法中最典型的則為CRISPR 方法。但是這類(lèi)篩選方法大多采用比較粗獷的篩選指標(biāo),如生長(zhǎng)速率、合成致死和熒光報(bào)告等方法。
混合基因敲除篩選(Pooled genetic knockout screens)在功能基因組學(xué)界廣泛用于鑒定與細(xì)胞表型相關(guān)的基因,而基因敲除方法中最典型的則為CRISPR 方法。但是這類(lèi)篩選方法大多采用比較粗獷的篩選指標(biāo),如生長(zhǎng)速率、合成致死和熒光報(bào)告等方法。
近年來(lái),隨著單細(xì)胞測(cè)序的普及,將其與混合基因敲除篩選法相結(jié)合,實(shí)現(xiàn)了全轉(zhuǎn)錄組范圍內(nèi)的定量分析,大大提升了篩選的通量。但是,這些方法仍然不能對(duì)亞細(xì)胞層面的表型進(jìn)行分析,如在成像層面能夠觀察到的時(shí)空分辨率下的一些表型。因此,將匯集的 CRISPR 基因篩選與細(xì)胞和亞細(xì)胞成像讀數(shù)相結(jié)合對(duì)于改善基于圖像的基因敲除研究中的表型定義至關(guān)重要。
2020年5月11日,加州大學(xué)圣地亞哥分校的華裔學(xué)者Gene W Yeo及其同事在Nature methods雜志上發(fā)表題為Pooled CRISPR screens with imaging on microraft arrays reveals stress granule-regulatory factors的研究論文。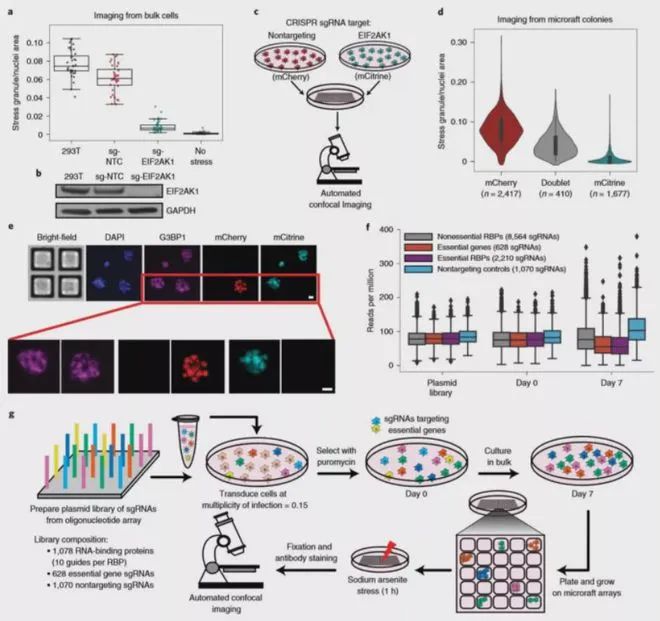
在這篇文章中,作者將 Pooled CRISPR-Cas9 篩選與微筏陣列(又稱(chēng)基因芯片)技術(shù)以及高內(nèi)涵成像相結(jié)合,開(kāi)發(fā)了新技術(shù)“CRaft-ID”。作者選用了包含 >1,000 個(gè) RBPs 的 gRNA 文庫(kù)(> 12,000 個(gè) sgRNA)對(duì)細(xì)胞進(jìn)行了感染,然后在 20 個(gè)微筏陣列上進(jìn)行單細(xì)胞培養(yǎng),篩選得到 119050 個(gè)應(yīng)激刺激后的單細(xì)胞集落和 5262 個(gè)未進(jìn)行應(yīng)激刺激的對(duì)照集落。隨后采用自動(dòng)高分辨率共聚焦成像來(lái)識(shí)別應(yīng)激顆粒的調(diào)節(jié)因子,并開(kāi)發(fā)了機(jī)器學(xué)習(xí)工具來(lái)識(shí)別 CRISPR 基因敲除后應(yīng)激顆粒豐度降低的基因克隆。
其中,微筏陣列的共聚焦成像是使用與 CrestOptics X-Light V2 L-FOV 旋轉(zhuǎn)盤(pán)共聚焦耦合的虹科 CELESTA 光源完成的。在這種大通量成像應(yīng)用中,顯微鏡光源需要具有極佳的光源強(qiáng)度和長(zhǎng)時(shí)間工作的穩(wěn)定性,虹科CELESTA 光源滿(mǎn)足所有嚴(yán)苛要求。虹科 CELESTA 光源的405 nm,520 nm,546 nm和638 nm線(xiàn)分別用于激發(fā)DAPI,mCitrine,mCherry和Alexa Fluor 633的熒光。該篩選鑒定并驗(yàn)證了六種以前已知的應(yīng)激顆粒調(diào)節(jié)劑,以及17種RNA結(jié)合蛋白(RBP)。當(dāng)它們耗盡時(shí),可減少亞砷酸鈉誘導(dǎo)的人體細(xì)胞中應(yīng)激顆粒,這為應(yīng)激顆粒提供了新的生物學(xué)見(jiàn)解。基于虹科 CELESTA 光源構(gòu)建的 CRaft-ID 篩選平臺(tái)拓展了 CRISPR 篩選在高內(nèi)涵成像中的應(yīng)用,使得我們能夠?qū)喖?xì)胞層面和細(xì)胞形態(tài)的表型進(jìn)行遺傳因子分析,而這些在以前是無(wú)法實(shí)現(xiàn)的。由于該方法采用的微筏陣列、通用的CRISPR文庫(kù)、現(xiàn)成的共聚焦成像技術(shù)和基于 PCR 的 DNA 測(cè)序,因此具有廣泛的應(yīng)用前景。
03虹科CELESTA光源介紹



虹科CELESTA
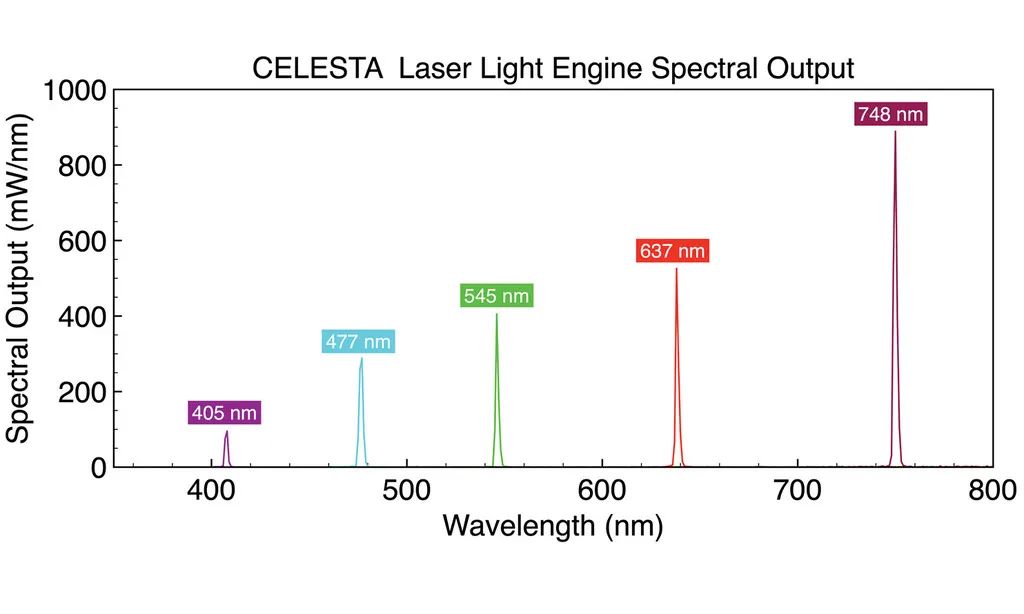
虹科 CELESTA 和 CELESTA quattro 光源包括4-7個(gè)可單獨(dú)控制的固態(tài)激光光源陣列(在400-800nm范圍提供7個(gè)可選波長(zhǎng)),并且支持快速切換。CELESTA 光引擎在1.5mm直徑光纖的遠(yuǎn)端出光,其7個(gè)激光器中的每一個(gè)都能提供約1W的輸出功率。
同樣,CELESTA quattro 光源以相同的輸出功率規(guī)格提供了一個(gè)具有性?xún)r(jià)比的4或5通道選擇。激光輸出與復(fù)雜的控制和監(jiān)測(cè)系統(tǒng)相結(jié)合,為旋轉(zhuǎn)盤(pán)共聚焦顯微鏡、空間分辨率轉(zhuǎn)錄組學(xué)和其它高級(jí)成像應(yīng)用提供所需的高清晰度性能。
-
光源
+關(guān)注
關(guān)注
3文章
731瀏覽量
68419
發(fā)布評(píng)論請(qǐng)先 登錄
蔡司激光共聚焦顯微鏡新品發(fā)布LSM910/990

虹科直播回放 | IO-Link技術(shù)概述與虹科IO-Link OEM

用于長(zhǎng)目標(biāo)物成像的線(xiàn)光源

分析共聚焦激光顯微鏡成像的常見(jiàn)問(wèn)題
共聚焦激光顯微鏡在材料科學(xué)中的應(yīng)用
共聚焦激光顯微鏡對(duì)比超分辨顯微鏡
共聚焦激光顯微鏡的光學(xué)系統(tǒng)解析
共聚焦激光顯微鏡的使用注意事項(xiàng)
共聚焦激光顯微鏡工作原理
測(cè)量表面粗糙度:白光共聚焦顯微鏡的優(yōu)點(diǎn)
什么是散射成像技術(shù)?
虹科直播 | 令你耳目一“新”的新能源車(chē)診斷分享

光片壽命成像
共聚焦顯微鏡有什么用?

共聚焦顯微鏡:成像原理、功能、分辨率與優(yōu)勢(shì)解析






 虹科案例|CELESTA光源用于Craft-ID技術(shù)的共聚焦成像
虹科案例|CELESTA光源用于Craft-ID技術(shù)的共聚焦成像










評(píng)論