催化劑的重構(gòu)現(xiàn)象普遍存在于許多多相反應(yīng)。目前,借助先進(jìn)的表征技術(shù)以及理論計(jì)算,我們已經(jīng)能夠探索、理解多種催化劑的重構(gòu)機(jī)制以及它們對(duì)催化反應(yīng)的利弊。然而,對(duì)于單原子催化劑,其重構(gòu)現(xiàn)象以及機(jī)理研究卻比較罕見。在許多情況下,我們都默認(rèn)它們?cè)诙嘞啻呋磻?yīng)中是穩(wěn)定的,特別是在反應(yīng)初始階段。
1. 電位驅(qū)動(dòng)單原子Cu催化劑在硝酸鹽還原反應(yīng)的結(jié)構(gòu)演變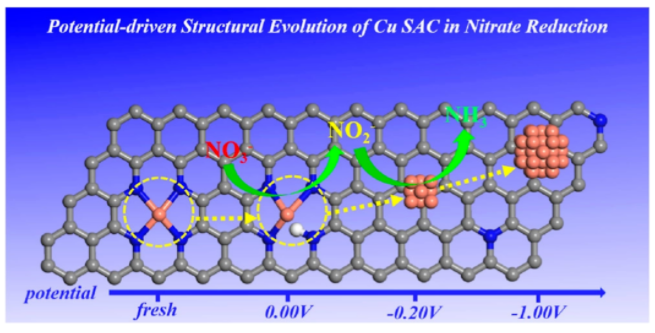
2.電位驅(qū)動(dòng)單原子Cu催化劑在氧還原反應(yīng)的結(jié)構(gòu)演變
盡管單原子Cu催化劑的重構(gòu)現(xiàn)象的研究取得了一定的進(jìn)展,然而,由于催化反應(yīng)不同,反應(yīng)介質(zhì)以及應(yīng)用電位也存在差異,目前仍難以清晰解釋單原子Cu催化劑的重構(gòu)現(xiàn)象。
最新成果介紹
德克薩斯大學(xué)奧斯汀分校劉遠(yuǎn)越教授、東南大學(xué)王金蘭教授等人以單個(gè)Cu原子嵌入N摻雜石墨烯為例,利用“恒勢(shì)混合溶劑化動(dòng)力學(xué)模型”,在實(shí)際反應(yīng)條件下評(píng)估了單原子Cu與Cu團(tuán)簇之間的可逆轉(zhuǎn)化。結(jié)果表明,H的吸附是單原子Cu從催化劑表面浸出的重要驅(qū)動(dòng)力。電極電位越負(fù),對(duì)H的吸附越強(qiáng),競(jìng)爭(zhēng)性析氫反應(yīng)受到抑制,Cu-N鍵發(fā)生減弱,導(dǎo)致Cu原子部分被錨定在催化劑表面,部分溶解在水溶液中。
在兩種狀態(tài)下Cu原子發(fā)生碰撞、形成瞬時(shí)Cu團(tuán)簇結(jié)構(gòu),成為促進(jìn)CO2還原為乙醇的真正催化活性位點(diǎn)。當(dāng)外加電位被除去或轉(zhuǎn)換為正電位時(shí),羥基自由基(OH?)將進(jìn)一步氧化Cu團(tuán)簇,Cu通過(guò)再沉積、恢復(fù)到初始的原子分散狀態(tài),最終完成催化劑的重構(gòu)循環(huán)。
因此,該工作提供了對(duì)Cu單原子催化劑在工況下的動(dòng)態(tài)穩(wěn)定性的基本理解,并呼吁考慮現(xiàn)實(shí)的反應(yīng)條件,重新評(píng)估目前報(bào)道的單原子催化劑的穩(wěn)定性。
圖文介紹
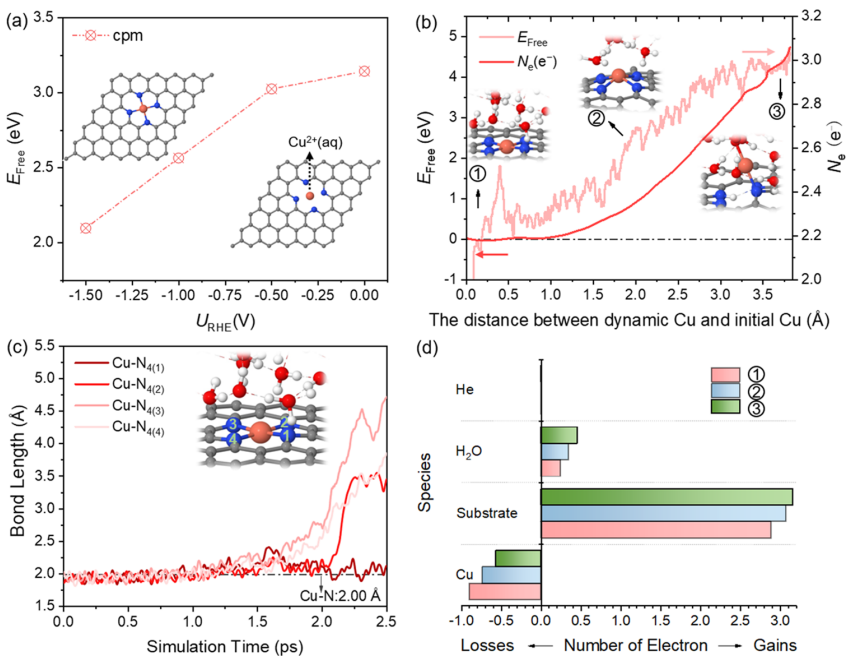
圖1. Cu浸出過(guò)程的熱力學(xué)和動(dòng)力學(xué)分析
圖1a顯示了在0 ~-1.5 V的不同電極電位下,Cu SA從表面浸出、形成Cu2+(aq)的自由能。雖然在-1.5 V時(shí)自由能降低到2.09 eV,但從熱動(dòng)力學(xué)上仍然很難從表面浸出。進(jìn)一步通過(guò)恒勢(shì)混合溶劑化動(dòng)力學(xué)模型評(píng)估了從表面浸出Cu的動(dòng)力學(xué)可能性。如圖1b所示,隨著Cu遠(yuǎn)離表面,自由能繼續(xù)增加,在反應(yīng)結(jié)束時(shí)達(dá)到4.74 eV。這表明Cu-N鍵不易斷裂,Cu SA不能在室溫下從表面浸出。
圖1c跟蹤了Cu-N的鍵長(zhǎng)隨Cu SA浸出過(guò)程的動(dòng)態(tài)演變。注意,當(dāng)Cu-N(3)鍵斷開時(shí),靠近N(3)原子的一個(gè)水分子發(fā)生水解,反應(yīng)結(jié)束時(shí)對(duì)應(yīng)的構(gòu)型為Cu原子只與一個(gè)N原子和一個(gè)?OH基團(tuán)配位。圖1b顯示了電子數(shù)隨結(jié)構(gòu)的變化而變化。與初始結(jié)構(gòu)相比,由于OH -的形成,最終結(jié)構(gòu)的凈電荷數(shù)增加到約0.7 e-。基于Bader電荷分析,如圖1d所示,Cu失去的電子數(shù)從初始結(jié)構(gòu)的0.9 e-下降到最終結(jié)構(gòu)的0.56 e-,說(shuō)明Cu SA發(fā)生價(jià)態(tài)降低、在遠(yuǎn)離表面處可被還原。因此,熱力學(xué)和動(dòng)力學(xué)結(jié)果都表明Cu SA幾乎不可能直接從表面浸出。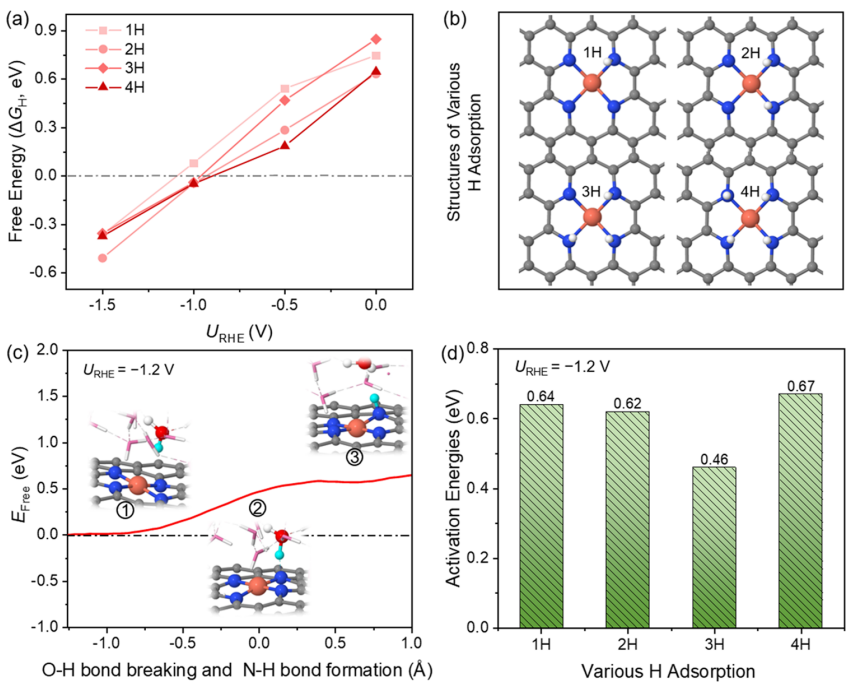
圖2.在催化劑表面的H吸附行為
然而,通過(guò)XAS表征,在原位CO2電解條件下原子分散的Cu2+和金屬Cu0團(tuán)簇之間確實(shí)存在結(jié)構(gòu)轉(zhuǎn)變。那么,具有強(qiáng)螯合能力的N4-C位點(diǎn)的Cu SA發(fā)生浸出、形成Cu團(tuán)簇的驅(qū)動(dòng)力是什么? 在此,探討了單原子Cu催化劑在CO2還原電位下H的吸附行為。圖2a、b分別顯示了不同外加電位下xH吸附的構(gòu)型與自由能。
當(dāng)電極電位由零變?yōu)樨?fù)時(shí),對(duì)應(yīng)的H吸附自由能由正變?yōu)樨?fù),說(shuō)明H在N位點(diǎn)的吸附從熱力學(xué)上由不利變?yōu)橛欣_@種轉(zhuǎn)變歸因于電位變得更負(fù),導(dǎo)致更多的電子聚集在催化劑表面,從而促進(jìn)H+的吸附。在U=-1.0 V時(shí)ΔGH接近于零,這解釋了為什么H2在-1.0 V時(shí)產(chǎn)率最高。在U=-1.2 V時(shí),由于H吸附顯著增強(qiáng),析氫反應(yīng)(HER)被有效抑制。
在此,推測(cè)H的吸附可能是影響Cu在負(fù)電位下解吸的重要因素。 因此,進(jìn)一步討論了H的來(lái)源。H的來(lái)源與H2O解離有關(guān)。因此,計(jì)算第一個(gè)H2O解離生成H*和OH-的動(dòng)力學(xué)勢(shì)壘。在?1.2 V時(shí)能壘為0.64 eV,說(shuō)明該反應(yīng)在室溫下很容易發(fā)生。反應(yīng)前后的電子數(shù)差約為0.8 e-,證實(shí)了OH-的生成。由于催化劑的結(jié)構(gòu)中含有4個(gè)N原子,可以為H吸附提供4個(gè)活性位點(diǎn),因此也計(jì)算了H占據(jù)的其余3個(gè)N位點(diǎn)的活化能,分別為0.62、0.46、0.67 eV。H2O解離生成*H和OH-的平均勢(shì)壘約為0.60 eV。因此,從熱力學(xué)和動(dòng)力學(xué)兩個(gè)方面驗(yàn)證了在U=-1.2 V時(shí),H2O分子中的H可以被吸附到N位點(diǎn)上。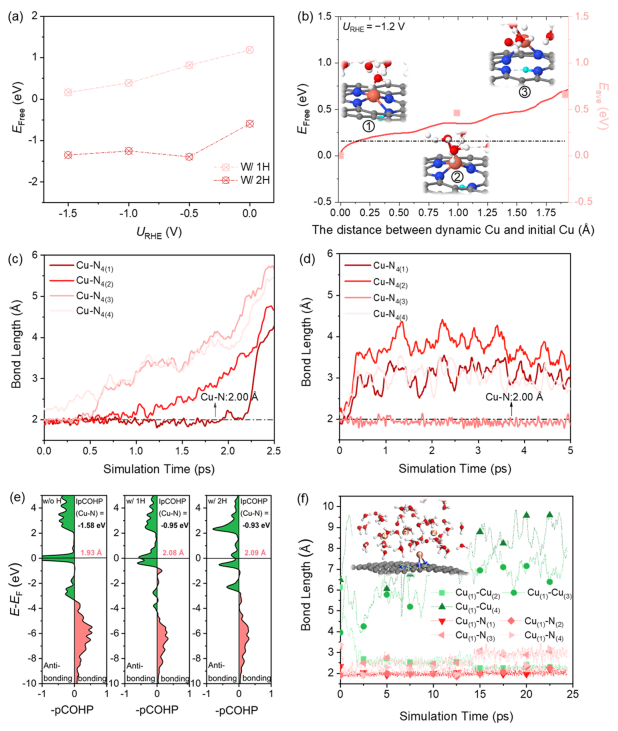
圖3. H吸附驅(qū)動(dòng)Cu從催化劑表面發(fā)生浸出
接下來(lái),需要考慮的是:在CO2還原過(guò)程中,H的吸附如何影響催化劑結(jié)構(gòu)的轉(zhuǎn)變? 計(jì)算1H和2H吸附下Cu SA浸出過(guò)程中Cu2+(aq)形成的自由能,如圖3a所示。隨著H的吸附,Cu SA與基底的結(jié)合強(qiáng)度減弱,形成了有利于Cu SA浸出的熱力學(xué)過(guò)程。而對(duì)于動(dòng)力學(xué),重新評(píng)估了Cu-N4-C中Cu SA浸出過(guò)程的動(dòng)力學(xué)勢(shì)壘,其中一個(gè)N位點(diǎn)被一個(gè)H位點(diǎn)吸附。如圖3b所示,當(dāng)活化能為0.70 eV時(shí),對(duì)應(yīng)于Cu與一個(gè)N原子和一個(gè)H2O分子發(fā)生配位。與純Cu-N4-C表面(4.74 eV)相比,H的吸附顯著促進(jìn)Cu SA的浸出。
如圖3c所示,當(dāng)模擬時(shí)長(zhǎng)為2.25 ps時(shí),Cu原子完全脫離表面,溶解在水溶液中,并吸附兩個(gè)H2O分子。圖3d顯示了Cu-N4的鍵長(zhǎng)(x,x=1~4)的動(dòng)態(tài)演變,表明在2H共吸附條件下,Cu SA在短時(shí)間內(nèi)(~ 300 fs)從表面自發(fā)浸出。所得到的最終構(gòu)型由一個(gè)Cu-N鍵和至少一個(gè)Cu-O鍵組成。因此,在動(dòng)態(tài)的電化學(xué)界面上,應(yīng)該同時(shí)存在Cu與一個(gè)N原子結(jié)合的不完全浸出、以及溶解在水中的完全浸出的兩種瞬時(shí)狀態(tài)。 在動(dòng)態(tài)環(huán)境下,兩種瞬時(shí)狀態(tài)的Cu原子發(fā)生碰撞形成瞬態(tài)Cu3/4團(tuán)簇結(jié)構(gòu),成為真正的催化活性中心。進(jìn)一步模擬了在工作條件下Cu原子的聚集過(guò)程。
從圖3f中可以觀察到,在AIMD過(guò)程中,兩個(gè)Cu原子的聚集小于2.5 ps, Cu(1)原子仍然錨定在N(1)和N(2)上。在15 ps時(shí),Cu(1)-Cu(2)的鍵長(zhǎng)進(jìn)一步縮短為2.26 ?, Cu(1)-N(3)和Cu(1)-N(4)的鍵長(zhǎng)分別拉伸為3.09和3.03 ?。一旦形成越來(lái)越多的Cu小團(tuán)簇,它們可以加速CO2的還原、形成乙醇。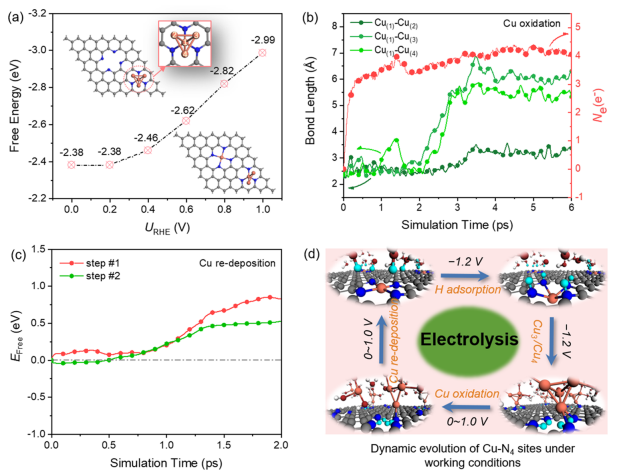
圖4. 在工況下Cu-N4位點(diǎn)的動(dòng)態(tài)演化
CO2還原反應(yīng)結(jié)束后,電極電位消失或升高至+1.0 V。此時(shí),Cu團(tuán)簇可以還原為原子分散的Cu2+。如圖4a所示,隨著電位的增加,Cu SA-Cu3生成的自由能越負(fù),即Cu SA-Cu3的生成越有利。 最近,一項(xiàng)實(shí)驗(yàn)研究證實(shí),HCO3-與H2O之間發(fā)生快速氧交換,促進(jìn)了高氧化性羥基自由基(OH?)的形成,從而促進(jìn)了Cu的快速再氧化。
因此,考慮在體系中引入兩個(gè)OH?自由基來(lái)評(píng)估+1.0 V下Cu4團(tuán)簇的再氧化過(guò)程。如圖4b所示,兩個(gè)OH?自由基分別在2 ps、0.5 ps后氧化Cu-Cu的第一配位殼層。在此之后,Cu(1)原子與其他三個(gè)或兩個(gè)Cu原子的距離越來(lái)越遠(yuǎn)。因此,與純水溶液相比,OH?自由基的存在在Cu的快速再氧化中起著主導(dǎo)作用。在氧化過(guò)程中,系統(tǒng)的凈電荷處于相對(duì)平衡狀態(tài),幾乎沒(méi)有額外的電子轉(zhuǎn)移到電極上,表明Cu團(tuán)簇被OH?自由基氧化為Cuδ+。
當(dāng)被OH?氧化后、形成Cu(H2O)3,此時(shí)Cu(H2O)3擴(kuò)散到N4-C位點(diǎn)鄰接處時(shí),即第1步,Cu從水溶液中遷移到與N原子配位,動(dòng)能勢(shì)壘為0.85 eV,發(fā)生了Cu再沉積過(guò)程。在這個(gè)反應(yīng)過(guò)程中,3個(gè)H2O分子返回水溶液中,Cu-N鍵的平均鍵長(zhǎng)為1.94 ?,與初始Cu-N鍵長(zhǎng)(1.95 ?)一致。也就是說(shuō),一旦Cu原子配位到1個(gè)N,Cu原子很快就會(huì)回到它最初的分散狀態(tài)。因此,在正電位下,高氧化的OH?與N4-C位點(diǎn)強(qiáng)螯合能力的協(xié)同作用,促進(jìn)Cu團(tuán)簇恢復(fù)到Cu SA狀態(tài),完成循環(huán)。
審核編輯:劉清
-
電極
+關(guān)注
關(guān)注
5文章
840瀏覽量
27677 -
電荷
+關(guān)注
關(guān)注
1文章
650瀏覽量
36638 -
負(fù)電位
+關(guān)注
關(guān)注
0文章
4瀏覽量
5622
原文標(biāo)題:JACS:?jiǎn)卧覥u催化劑在電催化反應(yīng)中的結(jié)構(gòu)演變
文章出處:【微信號(hào):清新電源,微信公眾號(hào):清新電源】歡迎添加關(guān)注!文章轉(zhuǎn)載請(qǐng)注明出處。
發(fā)布評(píng)論請(qǐng)先 登錄
中科催化新技術(shù)(大連)股份有限公司選購(gòu)我司熱重分析儀

Adv. Mater.:界面水調(diào)控促進(jìn)超低過(guò)電位下硝酸根還原產(chǎn)氨

原子的結(jié)構(gòu)在化學(xué)反應(yīng)中的作用
燃料電池的主要材料 燃料電池的效率和性能

覲嘉-催化劑磨損指數(shù)測(cè)定儀催化劑磨耗測(cè)試儀-視頻解說(shuō)

誠(chéng)衛(wèi)-催化劑磨損指數(shù)測(cè)定儀催化劑磨耗測(cè)試儀-解說(shuō)視頻

賽銳特-催化劑磨損指數(shù)測(cè)定儀催化劑磨耗測(cè)試儀-解說(shuō)視頻

理濤-催化劑磨損指數(shù)測(cè)定儀 催化劑磨耗測(cè)試儀-視頻解說(shuō) #催化劑磨損指數(shù)測(cè)定儀 #催化劑磨耗測(cè)試儀 #理濤
微反應(yīng)器在有機(jī)合成及催化中的應(yīng)用
實(shí)時(shí)原位監(jiān)測(cè)光電催化過(guò)程中反應(yīng)物濃度與熱效應(yīng)的微光纖傳感器技術(shù)
中國(guó)科大在納米級(jí)空間分辨紅外成像研究中取得新進(jìn)展
中國(guó)科大在納米級(jí)空間分辨紅外成像及催化研究中取得新進(jìn)展
催化燃燒設(shè)備數(shù)據(jù)采集遠(yuǎn)程監(jiān)控系統(tǒng)解決方案
網(wǎng)關(guān)助力催化劑產(chǎn)業(yè)升級(jí),解決痛點(diǎn)問(wèn)題!






 單原子Cu催化劑的重構(gòu)現(xiàn)象以及它們?cè)陔姶呋磻?yīng)的應(yīng)用
單原子Cu催化劑的重構(gòu)現(xiàn)象以及它們?cè)陔姶呋磻?yīng)的應(yīng)用










評(píng)論